Los enlaces químicos son las fuerzas que mantienen unidos los átomos para formar las moléculas. Hay tres tipos de enlaces entre átomos: metálico, iónico y covalente. Gracias a estos enlaces se forman todos los compuestos que existen en la naturaleza.
Además, existen fuerzas que mantienen unidas a las moléculas, que se conocen como enlaces intermoleculares, como son: fuerzas dipolo-dipolo y puentes de hidrógeno.
A continuación, te explicamos cada uno de estos enlaces.
| Tipos de enlace químico | Característica | Ejemplos | |
|---|---|---|---|
| Metálico | Los iones metálicos flotan en un mar de electrones en movimiento. | Elementos metálicos: sodio, bario, plata, hierro, cobre. | |
| Iónico | Transferencia de electrones de un átomo a otro. | Cloruro de sodio Na+Cl- | |
| Covalente | No polar | Comparte electrones de forma equitativa entre dos átomos. | Hidrógeno molecular H-H ó H2 |
| Polar | Comparte electrones de forma desigual entre dos átomos. | Molécula de agua H2O | |
| Simple | Comparte un par de electrones. | Molécula de cloro Cl2 Cl-Cl | |
| Doble | Comparte dos pares de electrones. | Molécula de oxígeno O2 O=O | |
| Triple | Comparte tres pares de electrones. | Molécula de nitrógeno N≣N o N2 | |
| Dativo | Solo uno de los átomos comparte los electrones. | Enlace entre el nitrógeno y el boro en el compuesto amoníaco-trifluoruro de boro. | |
| Fuerzas intermoleculares | Puente de hidrógeno | Los hidrógenos de una molécula son atraídos por los átomos electronegativos de otra molécula. | Los puentes de hidrógeno entre el hidrógeno de una molécula de agua con el oxígeno de otra molécula de agua. |
| Dipolo-dipolo | Moléculas con dos polos eléctricos atraen a los polos opuestos de otras moléculas. | Interacciones entre las moléculas de metanal H2C=O | |
Enlace metálico
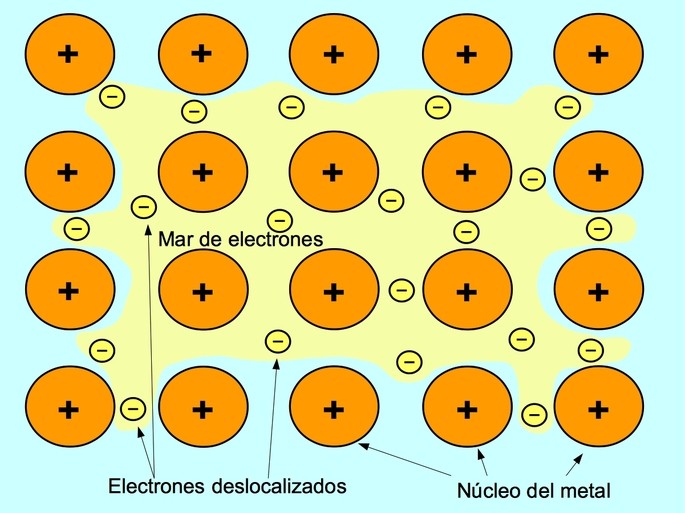
El enlace metálico es la fuerza de atracción entre los iones positivos de los elementos metálicos y los electrones negativos que se encuentran libres moviéndose entre los iones. Los átomos de metal están fuertemente empaquetados, esto permite que los electrones se muevan dentro de la red de átomos.
En los metales, los electrones de valencia se liberan de su átomo original y forman un “mar” de electrones que flota alrededor de la estructura completa del metal. Esto hace que los átomos de metal se transformen en iones metálicos con carga positiva que se empaquetan entre sí.
El enlace metálico se establece entre los elementos metálicos como el sodio Na, bario Ba, calcio Ca, magnesio Mg, oro Au, plata Ag y alumino Al.
Enlace iónico
El enlace iónico es la fuerza que une un elemento metálico, como el sodio o el magnesio, con un elemento no metálico, como el cloro o el azufre. El metal pierde electrones y se transforma en un ion metálico positivo llamado catión. Estos electrones pasan al elemento no metálico y se transforma en un ion cargado negativamente llamado anión.
Los cationes y aniones se combinan y forman una red tridimensional que se mantiene por las fuerzas de atracción electrostática entre los iones con cargas diferentes. Estas fuerzas forman los compuestos iónicos.
La corteza terrestre está formada principalmente por compuestos iónicos. La mayoría de las rocas, minerales y piedras preciosas son compuestos iónicos. Por ejemplo:
- El cloruro de sodio NaCl: el elemento metálico es el sodio que le transfiere un electrón al cloro, que es el elemento no metálico.
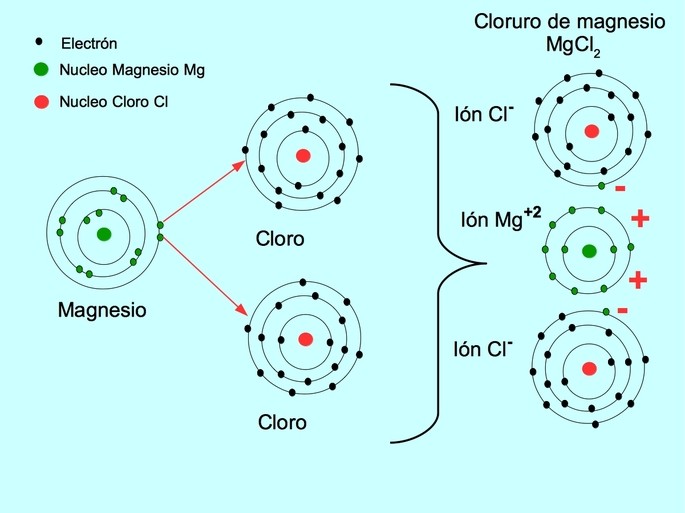
- El cloruro de magnesio MgCl2: el magnesio Mg dona dos electrones a dos átomos de cloro, como se muestra en la figura abajo:
Vea también Diferencia entre cationes y aniones.
Enlace covalente
El enlace covalente se forma cuando dos átomos no metálicos comparten electrones. Este enlace puede ser de varios tipos dependiendo de la afinidad por los electrones de los átomos y la cantidad de electrones compartidos.
Enlace covalente no polar
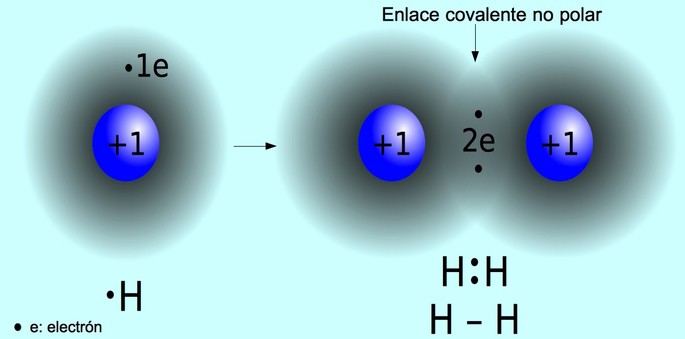
El enlace covalente no polar es el enlace que se forma entre dos átomos donde se comparten los electrones por igual. Este enlace ocurre normalmente en moléculas simétricas, es decir, moléculas formadas por dos átomos iguales, como la molécula de hidrógeno H2 y la molécula de oxígeno O2.
Enlace covalente polar
El enlace covalente polar se forma cuando dos átomos comparten electrones pero uno de ellos tiene una mayor atracción por los electrones. Esto hace que la molécula tenga un "polo" más negativo con mayor número de electrones y el polo opuesto es más positivo.
Las moléculas con esta distribución o desequilibrio de electrones se conocen como polares. Por ejemplo, en el fluoruro de hidrógeno HF, existe un enlace covalente entre el hidrógeno y el flúor, pero el flúor tiene mayor electronegatividad, por lo que atrae con más fuerza a los electrones compartidos.
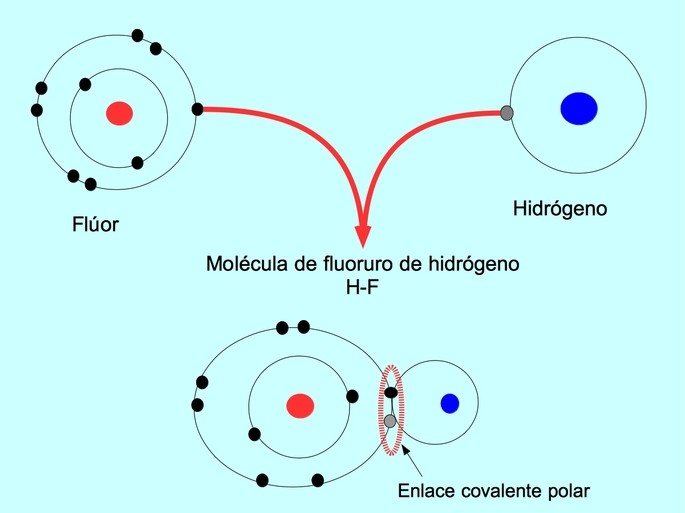
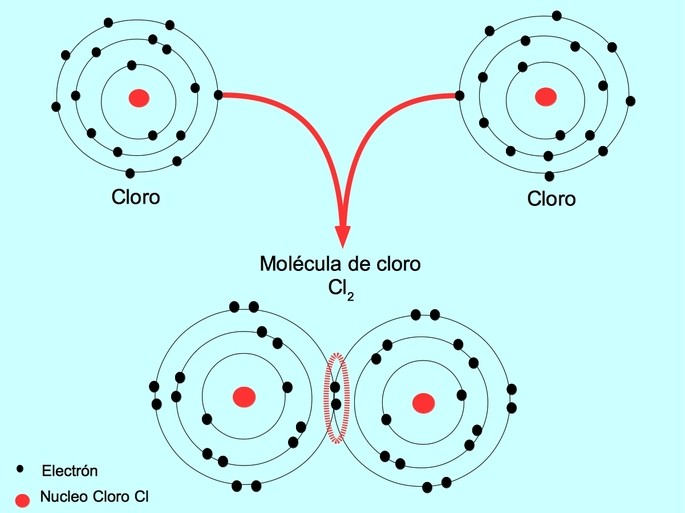
Enlace covalente simple
Cuando dos átomos comparten dos electrones, provenientes uno de cada uno, el enlace covalente formado se llama enlace covalente simple.
Por ejemplo, el cloro es un átomo que posee siete electrones de valencia en su capa externa, la cual puede llenarse con ocho electrones. Un cloro puede combinarse con otro cloro para formar la molécula de cloro Cl2 que es mucho más estable que los cloros por separados.
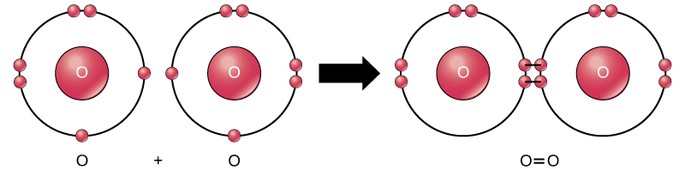
Enlace covalente doble
El enlace covalente doble es el enlace donde se comparten cuatro electrones (dos pares) de electrones entre dos átomos. Por ejemplo, el oxígeno tiene en su última capa 6 electrones. Cuando se combinan dos oxígenos, se comparten cuatro electrones entre los dos, haciendo que cada uno tenga 8 electrones en la última capa.
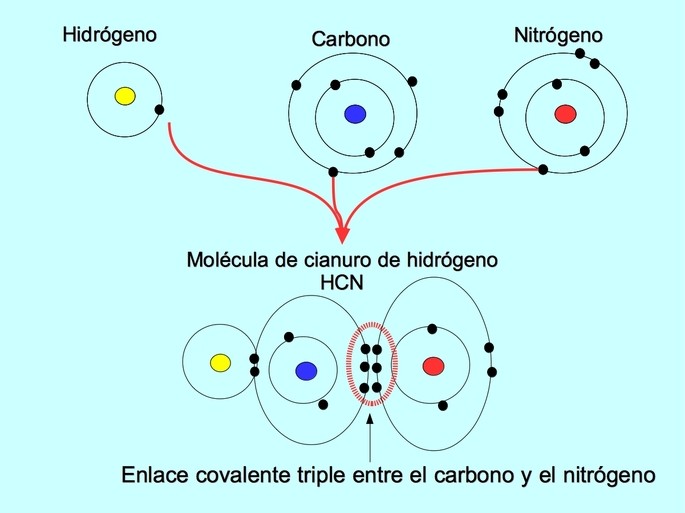
Enlace covalente triple
El enlace covalente triple se forma cuando entre dos átomos se comparten 6 electrones (o tres pares). Por ejemplo, en la molécula de cianuro de hidrógeno HCN, se forma un enlace triple entre el carbono y el nitrógeno, como se presenta en la figura abajo:
Enlace covalente coordinado o dativo
El enlace covalente coordinado o dativo es el enlace que se forma cuando solo uno de los átomos del enlace aporta un par de electrones. Por ejemplo, cuando reacciona el amoníaco NH3 con el trifluoruro de boro BF3, el nitrógeno se une con dos electrones directamente al boro, que no tiene electrones disponibles para compartir. De esta manera, tanto el nitrógeno como el boro quedan con 8 electrones en su capa de valencia.
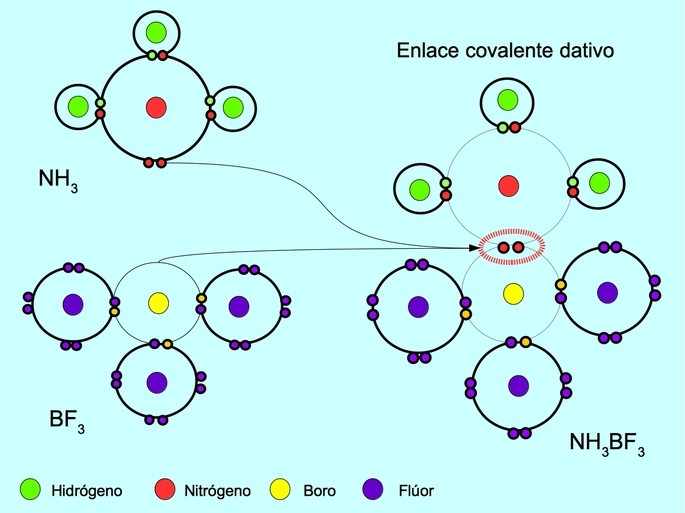
Vea también Compuestos orgánicos e inorgánicos.
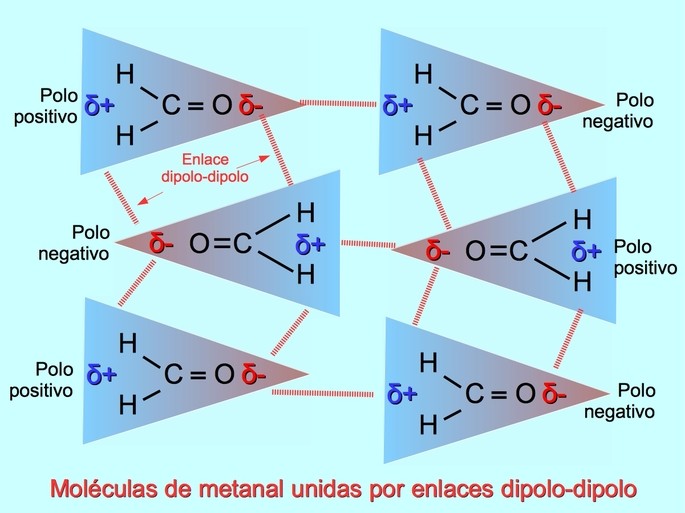
Enlaces o fuerzas dipolo-dipolo
Entre las moléculas polares se pueden establecer enlaces intermoleculares débiles cuando los polos negativos son atraídos por los polos positivos y viceversa. Por ejemplo, el metanal H2C =O es una molécula polar, con una carga parcial negativa sobre el oxígeno y una carga parcial positiva en los hidrógenos. El lado positivo de una molécula de metanal atrae al lado negativo de otra molécula de metanal.
Enlaces o puentes de hidrógeno
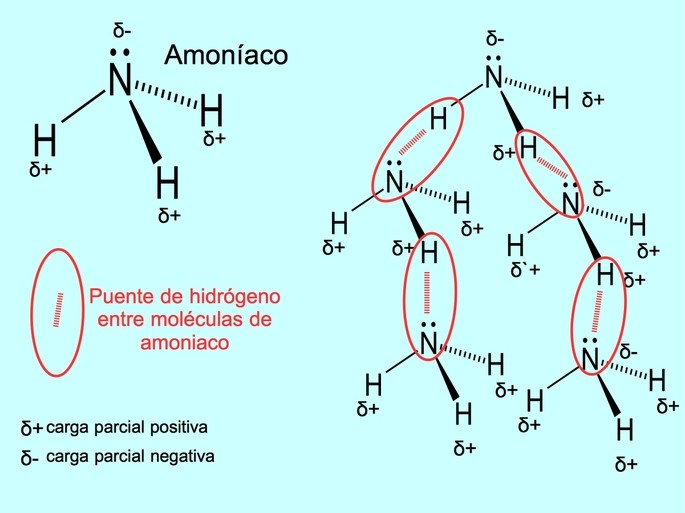
El puente de hidrógeno o enlace de hidrógeno es un enlace que se establece entre moléculas. Se produce cuando un hidrógeno de la molécula está unido covalentemente a un oxígeno, a un nitrógeno o a un flúor. El oxígeno, nitrógeno y flúor son átomos con una mayor electronegatividad, por lo tanto atraen con más fuerza los electrones cuando los comparten con otro átomo menos electronegativo.
Existen puentes de hidrógeno entre las moléculas de agua H2O y de amoníaco NH3 como se muestra en la figura:
Te puede interesar ver:
- Átomos y moléculas.
- Ejemplos de compuestos orgánicos e inorgánicos.
- Metales y no metales
- Tipos de reacciones químicas
- Ejemplos de reacciones quimicas
Referencias
Zumdahl, S.S., Zumdahl, S.A. (2014) Chemistry. Ninth Edition. Brooks/Cole. Belmont.
Commons, C., Commons, P. (2016) Heinemann Chemistry 1. 5th edition. Pearson Australia. Melbourne.