Una clasificación de los ácidos y bases en química depende de la fuerza de ionización de estas sustancias en medio acuoso. Así:
- un ácido y una base son fuertes cuando se ionizan completamente, es decir, en el proceso de ionización se transforman completamente en cationes o iones positivos y en aniones o iones negativos.
- Por otro lado, un ácido y una base son débiles cuando en el agua se ionizan parcialmente, esto es, en solución habrá una proporción de cationes, otra proporción de aniones y otra de moléculas no disociadas.
| Ácidos y bases fuertes | Ácidos y bases débiles | |
|---|---|---|
| Definición | Sustancias que en disolución se ionizan completamente. | Sustancias que en disolución se ionizan parcialmente. |
| Ionización | Completa | Parcial |
| Elementos en solución acuosa | Cationes y aniones en la misma concentración. | Cationes, aniones y moléculas en diferentes proporciones. |
| Constante de ionización | Elevada | Pequeña |
| Ejemplos |
|
|
Ácidos y bases fuertes
Un ácido o una base son fuertes cuando en un medio acuoso se disocian completamente, es decir, el proceso de ionización es total y en la solución se encontrará la misma concentración de aniones que de cationes.
¿Cómo se ioniza un ácido y una base fuerte?
Un ácido fuerte, como el ácido clorhídrico HCl, se ioniza de la siguiente forma:
![]()
Una base fuerte, como el hidróxido de sodio NaOH, se ioniza de la siguiente forma:
![]()
Ejemplos de ácidos fuertes y sus fórmulas
| Ácidos fuertes | Fórmula |
|---|---|
| Ácido clorhídrico | HCl |
| Ácido sulfúrico | H2SO4 |
| Ácido nítrico | HNO3 |
| Ácido bromhídrico | HBr |
| Ácido perclórico | HClO4 |
| Ácido crómico | H2CrO4 |
| Ácido tetraflurobórico | HBF4 |
Ejemplos de bases fuertes y sus fórmulas
| Base fuerte | Fórmula |
|---|---|
| Hidróxido de sodio | NaOH |
| Hidróxido de litio | LiOH |
| Hidróxido de potasio | KOH |
| Hidróxido de rubidio | RbOH |
| Hidróxido de cesio | CsOH |
| Hidróxido de calcio | Ca(OH)2 |
| Hidróxido de bario | Ba(OH)2 |
| Hidróxido de estroncio | Sr(OH)2 |
| Hidróxido de aluminio | Al(OH)3 |
Te puede interesar ver más ejemplos de ácidos y bases.
Ácidos y bases débiles
Un ácido o una base es débil cuando en solución acuosa se ioniza parcialmente, esto es, en la disolución se encuentra iones y moléculas no ionizadas.
¿Cómo se ioniza un ácido y una base débil?
Un ácido débil, como el ácido acético CH3COOH, se ioniza de la siguiente forma:
![]()
El equilibrio de esta reacción se expresa por las dos flechas en sentidos opuestos.
Cuando un ácido débil de disocia o ioniza, se establece un equilibrio entre las especies presentes en la solución; esto se puede expresar por una constante de ionización ácida:
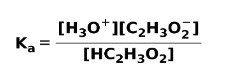
La constante de ionización no es más que la relación entre la multiplicación de la concentración de los productos sobre la multiplicación de la concentración de los reactantes.
Una base débil, como el amoníaco NH3, se ioniza de la siguiente forma:
![]()
Cuando una base débil de disocia o ioniza, se establece un equilibrio entre las especies presentes en la solución; esto se puede expresar por una constante de ionización de la base:
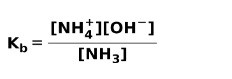
Te puede interesar saber la diferencia entre ácidos y bases.
Ejemplos de ácidos débiles con su fórmula y constante de ionización ácida Ka
| Ácido débil | Fórmula | Constante de ionización |
|---|---|---|
| Ácido fórmico | H2CO2 | 1,77 x 10-4 |
| Ácido acético | H3CCOH | 1,75 x 10-5 |
| Ácido cianhídrico | HOCN | 3,30 x 10-4 |
| Cianuro de hidrógeno | HCN | 6,20 x 10-10 |
| Ácido hipocloroso | HOCl | 3,50 x 10-8 |
| Ácido nitroso | HNO2 | 4,00 x 10-4 |
| Ácido láctico | HC3H5O3 | 1,40 x 10-4 |
| Ácido carbónico | H2CO3 |
4,30 x 10-7 5,60 x 10-11 |
| Ácido bórico | H3BO3 |
5,80 x 10-10 1,80 x 10-13 3,00 x 10-14 |
Ejemplos de bases débiles con su fórmula y constante de ionización básica Kb
| Base débil | Fórmula | Constante de ionización |
|---|---|---|
| Amoníaco | NH3 | 1,75 x 10-5 |
| Metilamina | CH3NH2 | 4,38 x 10-4 |
| Etilamina | C2H5NH2 | 5,60 x 10-4 |
| Anilina | C6H5NH2 | 3,80 x 10-10 |
| Piridina | C5H5N | 1,70 x 10-9 |
| Benzilamina | C7H9N | 2,20 x 10-5 |
| Bicarbonato de sodio | NaHCO | 2,00 x 10-4 |
Te puede interesar saber más sobre Características de los ácidos y bases







