Los protones, neutrones y electrones son las partículas que componen el átomo, que es la parte más pequeña del elemento. Estas partículas determinan las características y propiedades de los elementos químicos.
Los protones y neutrones se encuentran concentrados en el núcleo atómico, mientras los electrones están distribuidos en la corteza o la periferia del átomo. Un átomo tiene la misma cantidad de electrones y protones, mientras la cantidad de neutrones es variable.
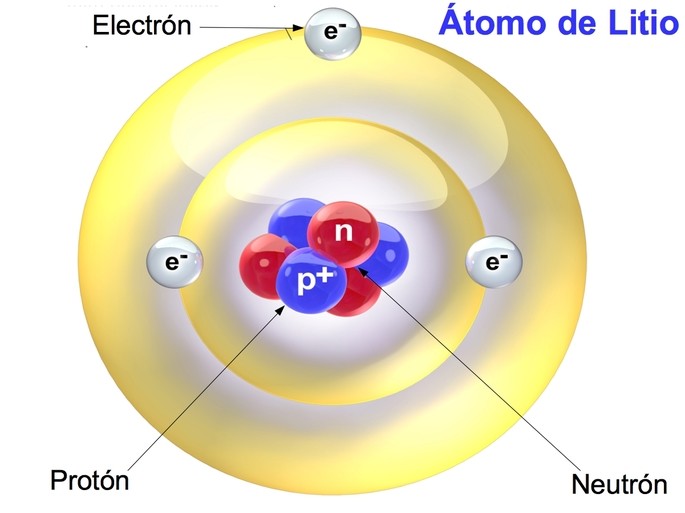
A continuación, te presentamos una tabla comparativa entre protones, neutrones y electrones.
| Protón | Neutrón | Electrón | |
|---|---|---|---|
| Definición | Partícula subatómica de carga positiva | Partícula subatómica de carga neutra | Partícula subatómica de carga negativa |
| Carga | Positiva +1 |
Neutra 0 |
Negativa -1 |
| Símbolo | p+ | n0 | e- |
| Localización en el átomo | Núcleo | Núcleo | Orbitales periféricos |
| Masa (kg) | 1,673 x 10--27kg | 1,675 x 10--27kg | 9,109 x 10--31kg |
| Masa comparada con el protón (amu) | 1 | 1 | 0,0005 |
| Partícula elemental | 3 cuarks: 2 u y 1 d | 3 cuarks: 2 d y 1 u | 1 leptón |
| Descubridor (año) | E. Rutherford (1911) | J. Chadwick (1931) | J.J.Thomson (1897) |
¿Qué es un protón?
Los protones son las partículas de carga positiva que se encuentran en el núcleo de un átomo. Cada átomo de un elemento tiene una cantidad fija de protones, lo cual determina su número atómico o Z. Asi, el hidrógeno tiene un protón y Z es igual a 1.
La masa del protón es 1,673 x 10-27 kg, que representa 1 unidad de masa atómica o amu (por sus siglas en inglés atomic mass unit).
En 1911, Ernest Rutherford descubrió que el núcleo de un átomo era diminuto y cargado positivamente, y de allí surgió el concepto del protón.
El protón está compuesto por unas partículas elementales llamadas cuarks o quarks: 2 cuarks u (por up=arriba) y 1 cuark d (por down=abajo).
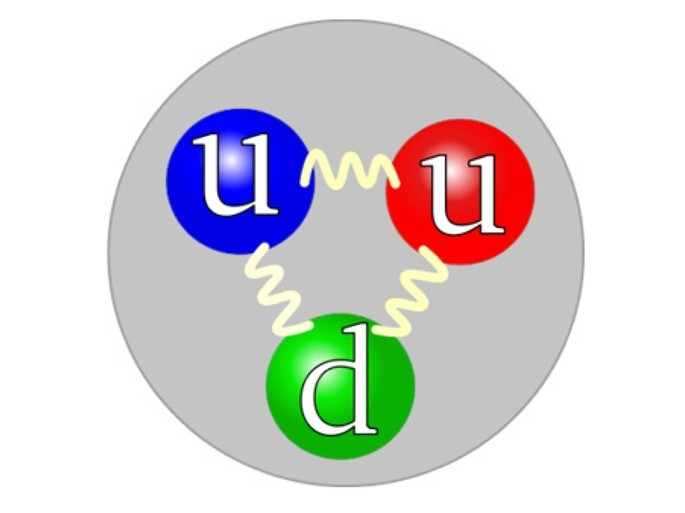
¿Cómo calcular los protones de un átomo?
La cantidad de protones de un átomo se puede determinar a partir de su número atómico, que es el número de posición en la tabla periódica.
Por ejemplo, el oro Au tiene como número atómico=79, quiere decir que el oro tiene 79 protones en su núcleo.
¿Qué es un neutrón?
Los neutrones son las partículas que se encuentran en el núcleo de un átomo junto con los protones. Se denotan por la letra n y tienen carga neutra. El único elemento que no posee neutrones es el hidrógeno.
La masa de los neutrones es muy similar al de los protones, por lo que la suma de las masas de los protones y los neutrones determina la masa atómica de un elemento.
Los átomos que tienen el mismo número atómico, pero diferente cantidad de neutrones se llaman isótopos. Por ejemplo, el deuterio es un isótopo del hidrógeno, que tiene un neutrón y un protón en el núcleo.
El físico inglés James Chadwick descubrió en 1931 esta partícula subatómica, con una masa aproximada al protón, pero con carga eléctrica neutra, por lo que fue llamada neutrón.
El neutrón está compuesto como el protón por cuarks: 1 cuark u (por up=arriba) y 2 cuarks d (por down=abajo).
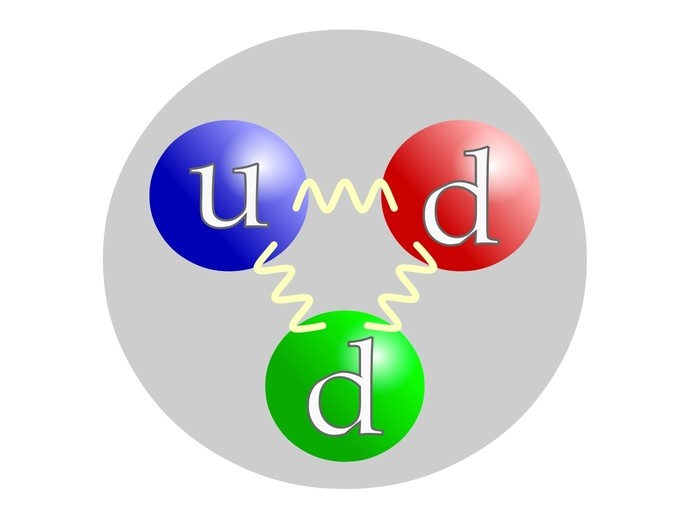
¿Cómo calcular los neutrones de un átomo?
Podemos calcular la cantidad de neutrones de un átomo si conocemos su masa atómica y su número atómico Z. Ya sabemos que el número atómico Z es la cantidad de protones y la masa atómica es la suma de protones y neutrones que tiene un átomo.
Por ejemplo, el oxígeno tiene una masa atómica de 16 y Z es 8. La cantidad de protones del oxígeno es igual a masa atómica menos Z:
16 - 8= 8 neutrones
¿Qué es un electrón?
Los electrones son las partículas del átomo que se encuentran en la nube que rodea al núcleo. Mientras protones y neutrones se concentran en el núcleo, los electrones se distribuyen en capas en el exterior.
Los electrones de la capa más externa de un átomo pueden saltar de un átomo a otro. Esto le otorga al átomo una carga eléctrica diferente; por ejemplo si un átomo gana un electrón, su carga será negativa, en cuanto si pierde un electrón, la carga será positiva.
Esto es lo que pasa en los iones, es decir, un átomo que gana o pierde uno o más electrones. Por ejemplo, el cloro tiene 17 electrones, pero puede ganar un electrón para transformarse en anión cloruro Cl-, con 18 electrones y una carga negativa.
El electrón fue descubierto en 1897 por J.J. Thomson, el mismo del modelo atómico del "pudin de pasas".
El electrón está compuesto por una partícula elemental que es el leptón.
La masa de un electrón es casi 2000 veces más pequeña que la del protón y el neutrón. Imagina que un protón o un neutrón fueran del tamaño de una bola de boliche de 3 kilos y medio, entonces el electrón sería del tamaño de una canica pequeña.
Por eso, la masa de los electrones en un átomo es despreciable cuando se calcula la masa atómica.
¿Cómo calcular los electrones de un átomo?
La cantidad de electrones de un átomo neutro es igual a la cantidad de protones que tiene ese átomo. Por ejemplo, el oro Au tiene 79 protones, por lo tanto, tendrá 79 electrones.
Te puede interesar ver también:
Referencias
Myers, R.L. (2005) The Basics of Physics. Greenwood.
Peake, B.M. (1989) The discovery of the electron, proton, and neutron. J.Chemical Education 66:738. DOI: 10.1021/ed066p738







